細胞内Ca2+の制御機構と生理機能の解析
Ca2+は主要な生理機構に必須と言えるほど極めて重要なシグナル分子であり、受精、筋収縮、神経伝達物質やホルモン分泌、シナプス可塑性といった広範かつ重要な生理機能の制御を担っています。一方で、細胞内Ca2+の動態や制御分子機構、生理機能との関連は未知のまま多く残されています。そのため、様々な細胞種におけるCa2+動態やその制御機構を明らかにすることは、それぞれの細胞における特徴的な生理機能を理解する上で非常に重要です。細胞内Ca2+濃度の変化は細胞膜及び小胞体膜のイオンチャネルや受容体などの分子で制御されており、細胞外の情報を細胞内へ伝達し、遺伝子発現などの多様な生理的応答へと変換することから、外部環境を生理反応へ変換するシグナル分子と捉えることができます。そこで、未だ動態や制御機構がよく知られていない細胞におけるCa2+動態とその制御機構を解明し、生理機能との関連を明らかとすることを目指して研究を行っています。この一環として、小胞体膜に発現するイオンチャネルに注目しています。小胞体からのCa2+放出は、筋肉の収縮、神経伝達物質や内分泌ホルモン放出など多くの細胞機能発揮に必要です。小胞体は細胞内Ca2+の貯蔵を担う細胞内小器官としての側面を持っており、小胞体に特徴的に発現する様々な遺伝子によりその機能が維持されています。これまでの解析から、小胞体膜タンパク質の機能についての理解が深まってきつつありますが、いまだその全容は不明です。そこで、特に非興奮性細胞における小胞体膜タンパク質の役割を明らかにすることにより、小胞体Ca2+放出の制御機構や生理機能を解き明かそうとしています。更に、得られた制御分子機構を利用した細胞の機能調節を行うことにより、新規作用機序による創薬応用に資する知見の取得へと展開したいと考えています。
最近の研究成果-1
TRICチャネルは京都大学薬学研究科にて2007年に発見された小胞体の陽イオンチャネルであり、小胞体からのCa2+放出反応を促進することが示唆されています。TRICチャネルには2つのサブタイプがあり、このうちのTRIC-Bチャネルは、I型コラーゲン非関連性の家族性骨形成不全症原因遺伝子の一つとして最近報告されました。しかし、その病態形成のメカニズムや、骨形成におけるTRIC-Bの生理機能は不明でした。本研究では、TRIC-Bチャネルが骨形成不全を引き起こす病態生理学的解析を行い、骨芽細胞においてTRIC-B欠損がカルシウムシグナル異常を引き起こし、コラーゲンの細胞内異常蓄積と細胞外への分泌不全から骨形成不全へとつながることを明らかとしました。本成果は、TRIC-B遺伝子変異による骨形成不全症の診断や治療に貢献することが期待されます。本成果は、米国の科学雑誌Science Signalingに掲載されました。
詳細は下記リンクも参照してください。
http://www.kyoto-u.ac.jp/ja/research/research_results/2016/documents/160518_1/01.pdf
http://dx.doi.org/10.1126/scisignal.aad9055
詳細は下記リンクも参照してください。
http://www.kyoto-u.ac.jp/ja/research/research_results/2016/documents/160518_1/01.pdf
http://dx.doi.org/10.1126/scisignal.aad9055
最近の研究成果-2
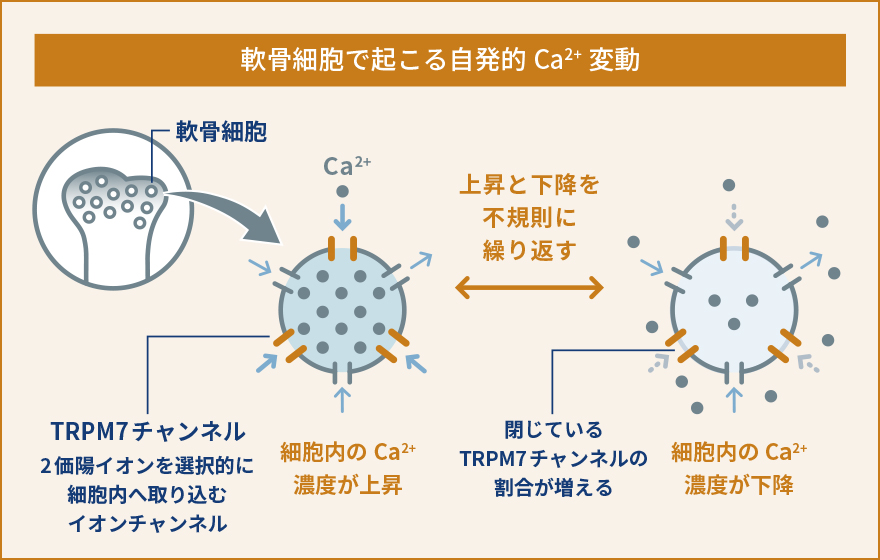
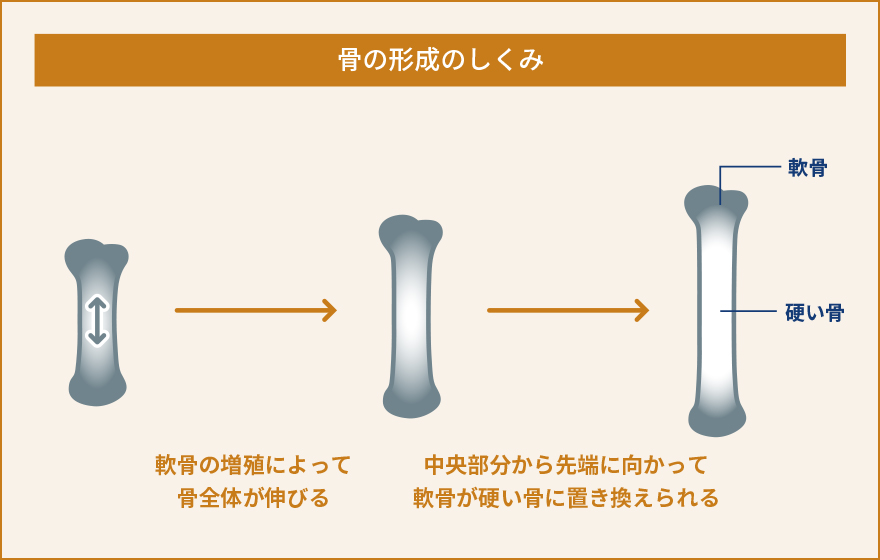
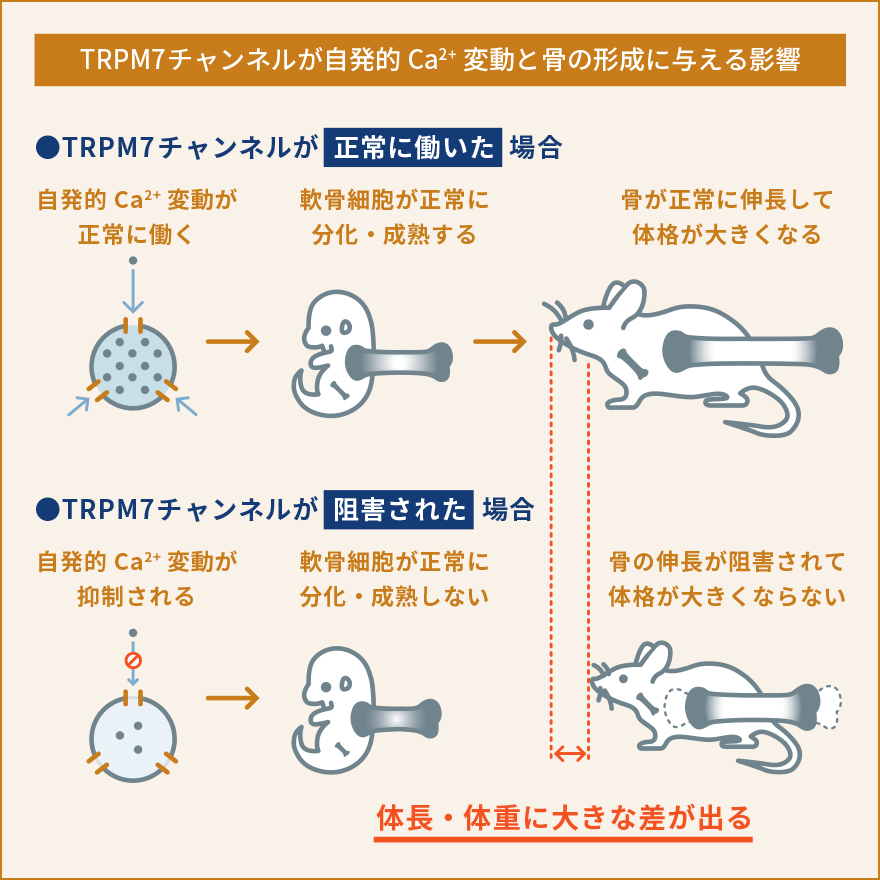
軟骨細胞は、軟骨組織を構成する唯一の細胞です。軟骨組織は血管や神経の直接的な影響を受けず、胎生期から発達の時期においては骨が長く伸びるため、関節軟骨として関節における摩擦を減らすために働くユニークな組織です。私達は、軟骨細胞における細胞内Ca2+の動態や生理的な役割があまり解明されていないことに気が付きました。軟骨細胞が関節のような立体的な組織として存在しているため、体の外で培養して同じような状態を保ち続けることがとても難しいという事情により、実験が難しく解析が進んでいなかったのです。そこで、私達は軟骨組織に存在する軟骨細胞を出来るだけそのままの状態で観察する手法を開発しました。すなわち、新生直前(胎生17.5日齢)のマウスから大腿骨を取り出し、およそ60µmという薄さでスライス培養試料を作り、これを用いて細胞内Ca2+の状態を観察するという新たな手法を確立しましたまず、新たに開発したスライス培養軟骨組織を使って軟骨細胞内でどのようにCa2+が振る舞っているのか観察しました。すると、これまで知られていなかった現象として、軟骨細胞内で細胞内Ca2+濃度が人為的な刺激がなくても自発的に上昇と下降を不規則に繰り返しているということを見つけました。そこでこの現象を自発的Ca2+変動と名付け、更に分子メカニズムや生理機能の解明を目指しました。いろいろな阻害薬を使って自発的なCa2+変動を阻害できるかどうか調べました。また、軟骨細胞において発現している遺伝子を網羅的に(一度にすべて)調べ、自発的なCa2+変動に関与していそうな遺伝子を絞り込みました。これらの薬理的な実験と遺伝子発現解析によって、自発的Ca2+変動を引き起こしている鍵分子の一つとして、TRPM7というイオンチャネルを見つけました。TRPM7は細胞膜に存在しており、Ca2+やMg2+などの2価の陽イオンを選択的に透過するイオンチャネルとして知られていますが、軟骨細胞における生理機能への関与はこれまで報告されていませんでした。TRPM7の阻害薬では自発的Ca2+変動が阻害され、TRPM7活性化薬を使うと自発的Ca2+変動は強くなりました。こういった一連の解析から、TRPM7を介して細胞内に流入してくるCa2+が自発的Ca2+変動を引き起こしていると結論しました。そこで次に、この現象が軟骨細胞のどういった生理的な機能に関与しているのか調べました。先にも書いたように、軟骨細胞は大腿骨や上腕骨、肋骨などのような長い骨が伸びていくときに必要です。長い骨が伸びるとき、軟骨がまず増殖し、骨の中央部分から先端側に向かって徐々に硬い骨に置き換えられていきます。こういった骨化を軟骨内骨化といいます。私達は、TRPM7が軟骨内骨化で担っている役割を解明する目的で、軟骨細胞でだけTRPM7が働かないようにしたマウスを作り出して解析しました。その結果、体外で培養したTrpm7遺伝子欠損指軟骨組織および、全身の軟骨細胞でTrpm7遺伝子が欠損した成体マウスの大腿骨のいずれにおいても、骨の伸長が著しく障害され、野生型と比較して短くなりました。また、骨をさらに細かく解析してみた結果、Trpm7遺伝子が働かないことで自発的Ca2+変動が抑制されるとともに、軟骨細胞の正常な分化成熟が阻害されていることがわかりました。流入したCa2+がCaMKIIという酵素を活性化して遺伝子発現を調節している可能性が高いこともわかり、軟骨において細胞内Ca2+が果たしている生理的な役割やその分子メカニズムの一端を解明しました。一連の研究から、軟骨細胞における自発的Ca2+変動という現象を発見するとともに、TRPM7チャネルがこれを調節し、軟骨細胞の正常な機能や分化成熟に必要であることを発見しました。TRPM7を遺伝子レベルで働かないようにしたり、阻害薬を使うことで軟骨機能が障害されて骨の伸長が阻害されたことから、人為的に骨の伸長を抑制し実験動物や家畜を小型化させるようなことが出来る可能性があります。実際に、TRPM7を軟骨細胞でのみ働かなくしたマウスは対照マウスと比較して生後も大きくならず、体格も体重も半分程度にとどまることがわかりました (概要図参照)。
本成果から、TRPM7の機能を調節することにより軟骨の伸長を制御できる可能性が示されました。さらなる研究により、移植培養軟骨の増殖促進・品質向上薬や、骨折治癒時における軟骨伸長促進薬など、TRPM7を標的とする新たな整形外科分野の治療薬創出へつながることが期待されます。
本成果は、2019年4月9日に米国の科学雑誌「Science Signaling」オンライン版に掲載されました。
詳細は下記リンクも参照してください。
http://www.kyoto-u.ac.jp/ja/research/research_results/2019/190410_1.html
食事中の脂肪酸を体内で感知する機構の解析
体外環境と生体内ホメオスタシスのコミュニケーション

近年の研究によって、GPR40 ファミリー(GPR40, 41, 43)やGPR120 等の遊離脂肪酸(短鎖、中鎖、長鎖)を天然リガンドとする受容体群が見出されました。すなわち、“脂肪酸受容体”という概念が確立されたことによって、脂肪酸が単なる栄養源としてだけでなく、シグナル伝達物質として様々な生理機能を担っていることが明らかとなってきました。これらの脂肪酸受容体は、食事中に含まれる遊離脂肪酸のみならず、体内で合成される遊離脂肪酸について、特定の鎖長・不飽和度のものを特異的に認識することで生理機能を発揮します。こういった特徴から、脂肪酸受容体は”外部環境と生体内ホメオスタシスとのコミュニケーション“を司っていると想定されます。そのため、脂肪酸受容体は、食事中に含まれる物質からのシグナルを感知して生体機能を制御するセン サーとして機能しており、脂肪酸受容体が中核となるエネルギー代謝制御システムが存在すると想定されます。現在までに私達は、長鎖遊離脂肪酸受容体GPR120 に注目し、これを欠損したマウスを作出して解析してきました。その結果、脂肪細胞に発現しているGPR120 が外部環境である高脂肪食に応じて脂肪細胞分化を制御し、全身のエネルギー代謝を調整していることを見つけました。GPR120 を全身で欠損したマウスは、高脂肪食負荷に依存して肥満し、糖尿病様の糖代謝異常を示すことが分かりました。更に、ヒトにおけるGPR120 非同義アミノ酸置換変異がGPR120 の機能不全を引き起こすとともに、肥満と相関すること発見しました (Ichimura et al., Nature)。このように、脂肪酸受容体はエネルギー代謝ホメオスタシスの調節に重要であり、その機能不全は肥満や糖尿病などの原因となる可能性があります。
現在、私達はGPR120を介した全身のエネルギー代謝調節機構を更に詳細に解明するべく複数の遺伝子改変マウスを作出して研究を行っています。複数の研究者との共同研究も精力的に実施しており、将来的にはGPR120を標的とした新薬の創製に資する知見を取得したいと考えています。